臨床研究、臨床試験、治験

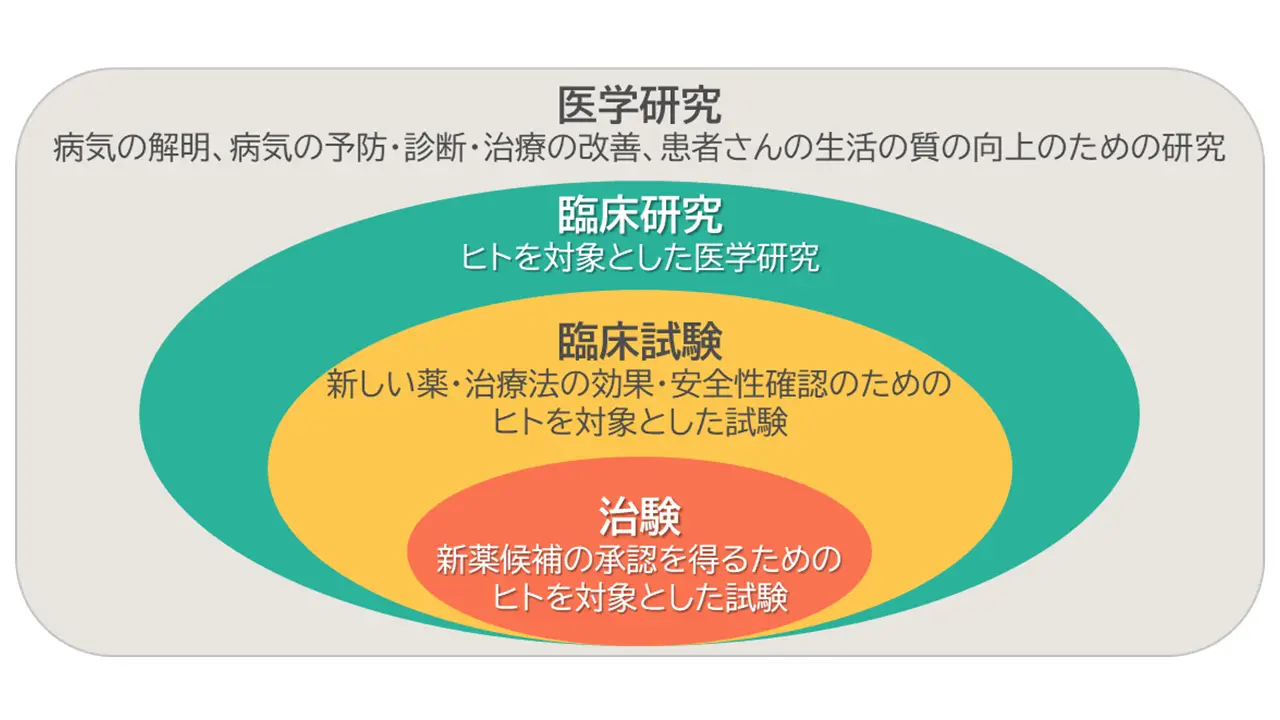
「臨床研究」はヒトを対象とした医学研究全般を指し、病気の解明、病気の予防・診断・治療の改善、患者さんの生活の質の向上などを目的として行われます。
「臨床研究」のうち、新しい薬や治療法の効果(有効性)や安全性を確認するために行われる試験は「臨床試験」と定義されます。
さらに「臨床試験」のうち、新薬の候補の承認を国(日本の場合は厚生労働省)から得ることを目的として行われる試験は「治験」と定義されます。
新薬の候補のための「治験」は、通常、第Ⅰ相、第Ⅱ相、第Ⅲ相の3つのステップで実施されます。
①第Ⅰ相試験(フェーズⅠ): 少数の健康なヒトを対象に実施します。新薬の候補の投与をごく少量から始め、少しずつ量を増やし、主に副作用などの安全性を確認します。
②第Ⅱ相試験(フェーズⅡ): 少数の患者さんを対象に、新薬の候補の有効性(効果)、安全性、使い方(投与量・投与間隔・投与期間など)を確認します。
③第Ⅲ相試験(フェーズⅢ): 第Ⅱ相試験で得られた結果を基に、多数の患者さんを対象に、新薬候補の有効性、安全性、使い方を最終的に確認します。その病気に対し標準的な薬や治療法がある場合はそれとの比較、ない場合はプラセボ(偽薬;外見は新薬候補と同じだが薬の有効成分が含まれていないもの)との比較となります。
(注: あくまでも一般的な定義であり、新薬候補の特性や対象となる病気により、治験のステップやその内容は異なります。)
治験に3~7年を要し、その前の基礎研究・非臨床試験(動物試験など)、その後の国での承認審査も含めると、新薬が製品として承認されて患者さんに届くまでには9~16年かかります。